Rad plina pri širenju
Plin koji se širi može izvršiti rad. Taj rad ovisi o načinu na koji se plin širi, a najjednostavnije ga je izračunati ako se širi pri stalnom tlaku.
Predpostavimo da se pri stalnom tlaku plin proširio od volumena $V_{1}$ do volumena $V_{2}$. Rad koji je plin pri tome izvršio je:
$$W=P\,\left ( V_{2}-V_{1} \right )$$
Budući da je pri širenju $V_{2} > V_{1}$, rad je pozitivan.
Ako okolina vrši rad nad plinom, plinu se volumen smanjuje. Tada je $V_{2} < V_{1}$ i rad je negativan
Ako promjenu volumena označimo s $\Delta V$, rad plina možemo zapisati kao:
$$W=P \Delta V$$
Kako biste bolje shvatili rad plina pri izobarnim procesima, proučite sljedeći applet.
Plin se nalazi u posudi sa pomičnim klipom. Prilikom širenja plin vrši rad. Prilikom sabijanja, okolina vrši rad.
Rad plina pomoću (P, V) dijagrama
Iz izraza za rad pri izobarnome procesu vidimo da se u (P, V) dijagramu rad može grafički odrediti kao površina pravokutnika. Pogledajte sljedeći applet
Ukoliko tlak nije stalan, rad možemo odrediti grafički kao pripadnu površinu u (P, V) dijagramu. Mišem možete mijenjati položaj dijelova grafa. Kliknite na potvrdni okvir pokaži točke i koristeći se mišem postavite točke prema želji. Osjenčana površina jednaka je izvršenom radu.
Sljedeći applet prikazuje izotermnu promjenu stanja plina. Osjenčana površina jednaka je izvršenom radu. Mijenjajte temperaturu i obratite pažnju kako se mijenja rad ako se temperatura povećava, odnosno smanjuje. Također možete mijenjati i položaje točaka A i B.
Prvi zakon termodinamike
Toplina je energija i ako ju dovodimo sustavu (npr. plin u posudi sa pomičnim klipom) ona može povećati unutrašnju energiju sustava ili omogućiti sustavu da vrši rad. To je opći zakon očuvanja energije.
$$Q=W+\Delta U$$
Česti se prvi zakon termodinamike zapisuje i ovako:
$$\Delta U= Q-W$$
Unutarnju energiju sustava možemo mijenjati dovođenjem ili odvođenjem topline i vršenjem rada.
Termodinamički procesi
Termodinamički parametri su fizikalne veličine koje opisuju termodinamički sustav:
- Broj čestica sustava
- Tlak
- Volumen
- Temperatura
Skup vrijednosti termodinamičkih parametara jednoznačno određuje termodinamičko stanje sustava.
Ako se stanje sustava tijekom vremena ne mijenja, kažemo da se radi o ravnotežnom stanju.
Sustav može promijeniti termodinamičko stanje spontano ili zbog djelovanja vanjskih sila. Promjenu termodinamičkog stanja nazivamo termodinamičkim procesom.
Termodinamički procesi mogu biti:
- povratni ili reverzibilni
To su procesi koji se mogu odvijati u oba smjera prolazeći kroz ista međustanja. U reverzibilnom procesu sistem prolazi kroz niz ravnotežnih stanja. - nepovratni ili ireverzibilni
Iz jednog stanja možemo prijeći u drugo, ali se u početno stanje ne možemo vratiti prolazeći kroz ista međustanja. Svi realni termodinamički procesi su ireverzibilni. Iz početnog stanja sistem će prijeći u stanje termodimnamičke ravnoteže, ali se prijelaz u obrnutom smjeru neće dogoditi.
Kružni procesi. Toplinski stroj
Termodinamičke procese u kojima se plin vrati u početno stanje nazivamo kružnim procesima. Jedan takav proces vidimo na crtežu.
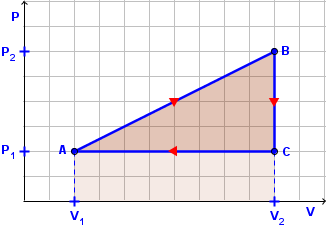
Plin prelazi iz stanja A u stanje B, zatim iz stanja B u stanje C i na kraju iz stanja C u stanje A, tj. u početno stanje. Time je plin napravio kružni proces i vratio se u početno stanje.
- Proces A - B
Plin se širi i vrši rad koji je jednak površini trapeza: $W_{AB}=\frac{1}{2}\left ( P_{1}+P_{2} \right )\left ( V_{2}-V_{1} \right )$. Unutarnja energija mu raste: $\Delta U_{AB}=U_{B}-U_{A}$. Budući da su i rad i promjena unutrašnje energije pozitivni, plin prima toplinu: $Q_{AB}=W_{AB}+\Delta U_{AB}$. - Proces B - C
Promjena je izohorna, pa je rad jedank nuli: $W_{BC}=0$. Unutrašnja se energija smanjuje: $\Delta U_{BC}=U_{C}-U_{B}$. Prema tome, plin predaje toplinu: $Q_{BC}=\Delta U_{BC}$. - Proces C - A
Plin sabijamo pa okolina vrši rad koji je jednak površini pravokutnika: $W_{CA}=P_{1}\left ( V_{1}-V_{2} \right )$. Rad je negativan. Unutrašnja se energija smanjuje: $\Delta U_{CA}=U_{A}-U_{C}$. Plin predaje toplinu: $Q_{CA}=W_{CA}+\Delta U_{CA}$.
Za cijeli kružni proces vrijedi:
Promjena unutrašnje energije jednaka je nuli. Ne moramo zbrajati sve tri promjene, nego možemo lako zaključiti, jer se plin vratio u početno stanje. Dakle:
$$\Delta U=0$$
Plin je primio toplinu:
$$Q_{1}=Q_{AB}$$
Plin je predao toplinu:
$$Q_{2}=Q_{BC}+Q_{CA}$$
Plin je izvršio rad kojega dobijemo zbrajanjem radova u procesima A-B i C-A. Lakše je to odrediti grafički kao površinu osjenčanog trokuta:
$$W=\frac{1}{2}\left ( P_{2}-P_{1} \right )\left ( V_{2}-V_{1} \right )$$
Na ovom principu zasnovan je rad toplinskih strojeva , koji toplinu pretvara u rad. Toplinski se stroj sastoji od tri dijela:
- radno tijelo
To može biti plin u cilindru sa pokretnim klipom. Zagrijavamo ga pomoću toplijeg spremnika koji mu predaje toplinu $Q_{1}$. Jedan dio te topline, $Q_{2}$ radno tijelo predaje hladnijem spremniku, a ostatak se koristi za pogon stroja. - toplinski spremnik više temperature $T_{1}$
To je izvor energije. Energija se može dobiti izgaranjem nekoga goriva. - toplinski spremnik niže temperature $T_{2}$
Za hladniji se spremnik uzima neko tijelo iz okoline, npr. voda.
U jednom kružnom procesu radno tijelo izmijeni energiju sa oba spremnika i pri tome izvrši neki rad, te se vrati u početno stanje. Kružni se proces može ponavljati i tako stroj može neprekidno vršiti rad. Koliki je koristan rad stroja u jednom kružnom procesu? Prema prvom principu termodinamike je:
$$Q=W+\Delta U$$
Primijenimo ovo na cijeli kružni proces. Plin je dobio toplinu $Q_{1}$ od toplijeg spremnika, dok je hladnijem spremniku predao toplinu $Q_{2}$. Možemo reći da je "netto" dobivena toplina jednaka $Q_{1}-\left | Q_{2} \right |$. Promjena unutrašnje energije je $\Delta U = 0$. Ako to uvrstimo u prvi princip termodinamike, dobijemo da je u jednom kružnom procesu plin izvršio koristan rad:
$$W=Q_{1}-\left | Q_{2} \right |$$
Korisnost toplinskog stroja, $\eta$, definiramo kao omjer između korisnoga rada i utrošene energije:
$$\eta =\frac {W}{Q_{1}}$$
Korisnost često prikazujemo ovako:
$$\eta =\frac {Q_{1}-\left | Q_{2} \right |}{Q_{1}}$$
Vidimo da je korisnost toplinskog stroja uvijek manja od jedan: $\eta <1$. Gubici kod toplinskih strojeva su veliki, pa je korisnost toplinskih strojeva nešto iznad 40%.
Carnotov kružni proces
Napomena:
Adijabatska promjena stanja plina je ona promjena pri kojoj nema izmjene topline,
$Q=0$, pa iz prvoga principa termodinamike slijedi:
$$W=-\Delta U$$
Plin vrši rad na račun svoje unutrašnje energije ako se širi, odnosno, pri sažimanju mu se unutrašnja energija povećava zbog rada kojega vrši okolina.
Od svih kružnih procesa, najveću korisnost ima Carnotov kružni proces. Zbog toga ga nazivamo i idealnim kružnim procesom. To je proces koji se sastoji od:
- Izotermičkog širenja pri temperaturi toplijeg spremnika $T_{1}$ (A-B)
Plin prima toplinu od toplijeg spremnika, a unutrašnja mu se energija ne mijenja: $$T_{1}=konst\Rightarrow \Delta U=0\Rightarrow W_{AB}=Q_{1}$$ - adijabatskog širenja (B-C)
Nema izmjene topline sa spremnicima. Plin se širi na račun unutrašnje energije koja se smanjuje:
$$Q=0\Rightarrow W_{BC}=-\Delta U$$ - izotermičkog sažimanja (kompresije) pri temperaturi hladnijeg spremnika $T_{2}$ (C-D)
Okolina vrši rad. Unutrašnja je energija konstantna, a plin predaje toplinu hladnijem spremniku: $$T_{2}=konst\Rightarrow \Delta U=0\Rightarrow W_{CD}=-\left |Q_{2} \right |$$ - adijabatskog sažimanja do početnog tlaka i volumena (D-A)
Nema izmjene topline sa spremnicima. Plin sabijamo pa mu unutrašnja energija raste: $$Q=0\Rightarrow W_{DA}=\Delta U$$
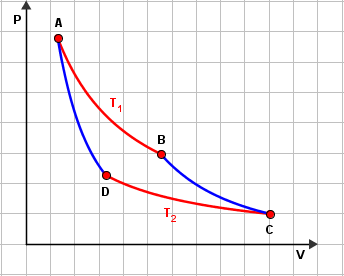
Kod Carnotovog kružnog procesa vrijedi:
$$\frac{Q_{2}}{Q_{1}}=\frac{T_{2}}{T_{1}}$$
pa se korisnost Carnotovog procesa može prikazati kao:
$$\eta =\frac{T_{1}-T_{2}}{T_{1}}=1-\frac{T_{2}}{T_{1}}$$
Drugi zakon termodinamike
U termodinamičkom sustavu koji se sastoji od dva tijela različitih temperatura, unutrašnja energija može, sama po sebi, prelazati samo sa tijela više na tijelo niže temperature. Prijelaz topline sa hladnijeg na toplije tijelo spontano se ne može dogoditi, nego je moguć samo uz utrošak rada.
Ovo je bila jedna od formulacija drugog zakona termodinamike, koja objašnjava zaštu su termodinamički procesi nepovratni. Ovaj zakon možemo formulirati i ovako:
Ne postoji termodinamički proces u kojemu bi jedini rezultat bio pretvorba topline u mehanički rad.