Entropija
Termodinamički procesi odvijaju se na način da sustav, na kojega nema vanjskih djelovanja, prelazi iz uređenih stanja u manje uređena stanja. Postoji jedna veličina, koja se naziva entropija, i koja služi kao mjera za uređenost sustava. Uređen sustav ima nisku entropiju, a neuređen sustav visoku.
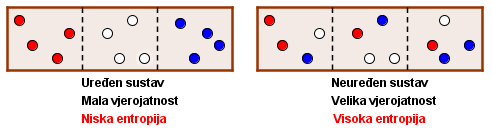
Entropija sustava povećava se sve dok ne nastupi termodinamička ravnoteža.
Drugi zakon termodinamike možemo formulirati i pomoću entropije:
Entropija zatvorenog sustava ne može se smanjivati. Ona raste sve dok ne nastupi termodinamička ravnoteža i tada se više ne mijenja.
Gibanje molekula - aplet
Mijenjajte broj molekula i pokrenite animaciju. Opažate li odstupanja od zakona porasta entropije za mali broj molekula, recimo za N = 2, 4, ... ? A za veći broj molekula, npr. N = 64, 128, ... ?
Ako u nekom dijelu zatvorenog sustava i dođe do smanjenja entropije, u drugom dijelu istoga sustava dolazi do njezinog povećanja, pri čemu je to povećanje veće, pa ukupna entropija sustava ipak raste.
Statističku interpretaciju entropije dao je Ludwig Boltzmann (1866.):
Entropija, S, je proporcionalna logaritmu termodinamičke vjerojatnosti, B: S = k·ln B.
Termodinamička vjerojatnost jednaka je broju različitih mikrostanja koja odgovaraju danom makroskopskom stanju. Pojednostavljeno, u našem primjeru, jedno makrostanje odgovaralo bi jednakom broju molekula u L (npr. 64) za sve moguće raspodjele. U klasičnoj statističkoj fizici možemo razlikovati molekule. ln je prirodni logaritam, dakle, logaritam po bazi e = 2.71828182846..., dok je k = 1.3806503·10-23 J/K Boltzmannova konstanta. Ova je formula uklesana u Boltzmannov nadgrobni spomenik.
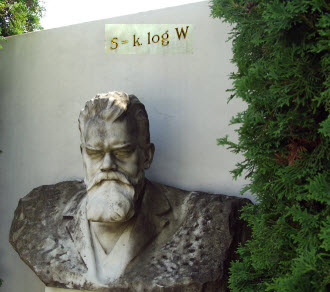
Kao što nam je poznato, vrijeme teče samo u jednom smjeru, od prošlosti prema budućnosti. To tumačimo drugim zakonom termodinamike. Kada bi vrijeme teklo u suprotnom smjeru, entropija bi se smanjivala, a to nije moguće.
U prirodi ne postoji niti jedan proces koji se ne pokorava drugom zakonu termodinamike, odnosno, zakonu da se entropija zatvorenog sustava ne može smanjivati. To vrijedi i za cijeli svemir. Entropija svemira ne može se smanjivati. U vezoi s tim, pojavila se mogućnost toplinske smrti svemira. Jednom će doći vrijeme kada će cijeli svemir poprimiti maksimalnu entropiju. Tada će svi dijelovi svemira imati jednaku temperaturu i više neće biti moguća pretvorba topline u rad, pa će svemir umrijeti toplinskom smrću. Nije bitno nakon koliko dugo vremena će do toga doći (desetak milijardi godina ili više.) Perspektiva nije utješna.No, izgleda da do toga ipak neće doći zbog fluktuacija.
Fluktuacije
Kada je sustav prepušten samome sebi, prijeći će u stanje termodinamičke ravnoteže, i pri tome će entropija biti maksimalna. Međutim, entropija se u nekom kratkom vremenskom intervalu može smanjiti, iako će sustav većinu vremena biti u stanju maksimalne entropije. Ova mala privremena odstupanja od ravnotežnog stanja nazivamo fluktuacijama. Fluktuacije oko ravnotežnog stanja stalno se događaju. Ta su odstupanja jako mala. Veća se odstupanja rijetko događaju. Vjerujemo da upravo zbog fluktuacija svemir neće doživjeti toplinsku smrt.
Vjerojatnost fluktuacija možemo odrediti kao: $$P_{f}\sim \frac{B}{B_{m}}$$
B je termodinamička vjerojatnost fluktuacije, a Bm je termodinamička vjerojatnost najvjerojatnijeg stanja (stanje termodinamičke ravnoteže.)